플라즈마 방전 시 세포 내 활성 산소종 생성효소 발현

현진원
의학전문대학원
생화학교실 교수
2013년 KAIST 공대 교수님의 소개로 공학 관련 연구자로 구성된 플라즈마(plasma) 연구회에 참석했다. 그 당시 이 연구회에서는 필자가 연구하고 있는 활성 산소종(Reactive Oxygen Species, ROS) 분야에 관해 관심이 있었다. 대부분 공학 관련 연구자로 구성된 모임이었기에 단 한 명의 기초의학 관련 연구자로 참석한 필자에게는 어색한 첫 만남이었다.
당시 플라즈마란 혈액의 구성성분 또는 세포 원형질로 알고 있었기 때문에 “왜 공학 관련 연구회에서 이들을 연구할까”하는 의문이 있었는데 이는 필자가 아는 플라즈마와는 전혀 다른 세계였다.
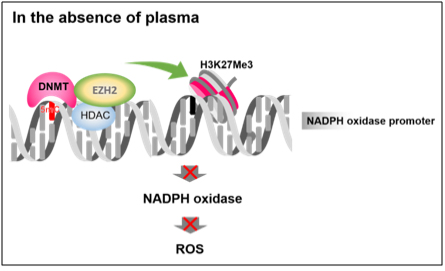
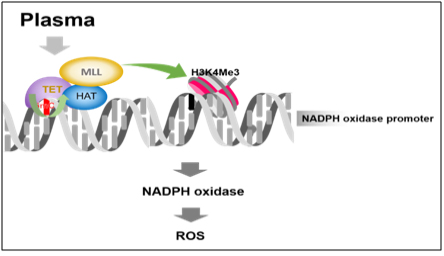
NADPH 산화효소의 발현을 억제함으로써 활성 산소종이 생성되지 않는다(위).
NADPH 산화효소 발현을 유도함으로써 활성 산소종이 생성된다(아래).
플라즈마는 고체, 액체, 기체 다음으로 제4의 물질 상태로서 이온, 전자기파, 활성 산소종 등의 복합체로, 이해하기 쉬운 자연현상은 번개이다. 플라즈마의 물리적, 화학적 원리에 대해 공학자들의 발표를 들으면서 이해되면서도 이해되지 않는 필자의 어정쩡한 머리를 탓했다. 하지만 서로 영역이 다른 공학자들과의 연구모임은 흥미롭고 색달랐으며, 그때 융합연구의 중요성을 다시 한번 크게 깨달았다.
플라즈마의 적용 범위는 다양하며 의료 분야에서는 피부에 생기는 상처 및 암 치료 분야에 시도되고 있었고, 특히 생체의학 적용에 가능한 대기압 저온 플라즈마를 바이오 플라즈마(bio-plasma)라고 했다.
문헌에 의하면 플라즈마를 세포에 처리 시 세포 내 생성되는 활성 산소종은 플라즈마 자체 또는 물 분자와 반응해 생성되는 활성 산소종이라는 보고가 대부분이었다.
참고로 체내에서 활성 산소종은 산소(O2)가 4개의 전자를 받으면서 독성이 없는 물(H2O)을 만드는 도중에 생겨나는 부산물로 주로 호흡 과정에서 일어나는 부산물이다. 즉, 산소가 전자를 한 개 받아 슈퍼옥사이드(superoxide, O2-.)를 생성하는데 이 물질은 매우 불안정하여 세포 내에서 항산화 효소인 슈퍼옥사이드 제거효소(superoxide dismutase)의 작용에 의해 과산화수소(hydrogen peroxide, H2O2)를 생성한다.
과산화수소는 슈퍼옥사이드 보다 안정적인 물질이고 세포 내에서 그 생성이 잘 조절돼서 대부분은 세포 내의 항산화 효소인 과산화수소 제거효소(catalase, glutathione peroxidase 등)에 의해 독성이 없는 H2O로 제거된다. 그러나 세포가 조절하지 못할 정도의 많은 양의 과산화수소가 생성되고 세포 내에서 이를 적절하게 제거하지 못하는 상태에서는 과산화수소가 전자를 한 개를 더 받아 하이드록실 라디칼(hydroxyl radical, OH.)이 생성된다.
아쉽게도 세포 내에는 이를 제거하는 항산화 효소가 없고, 이 물질은 독성이 매우 강해 대부분 세포 내 활성 산소종의 독성은 이 물질로부터 유래가 된다. 대표적인 활성 산소종은 수퍼옥사이드, 과산화수소, 하이드록실 라디칼 등을 포함한다.
하지만 활성 산소종은 단순히 호흡 과정에서 생성되는 부산물 이외에도, 외부자극에 의해 세포막에 존재하는 수용체를 통해 일시적으로 생성되는 세포 신호전달 체계의 이차 신호전달물질(second messenger)로서도 작용한다. 외부자극에 의한 활성 산소종은 주로 세포막에 존재하는 NADPH 산화효소(NADPH oxidase, NOX)에 의해 생성되며, 일정 기간 이차 신호전달물질로 활동한 후 세포 내의 또 다른 항산화 효소 체계 퍼옥시레독신(peroxiredoxin)과 설피레독신(sulfiredoxin) 등에 의해 제거된다.
활성 산소종의 대표적 생성 효소 시스템인 NADPH 산화효소는 전자전달에 관여하는 막 단백질(membrane protein) 효소로서 주요한 기능은 활성 산소종 생성이다. 세균 등의 감염으로부터 방어 작용하는 호중구(neutrophil) 등의 식세포(phagocyte)에서 처음 발견됐으며, 막에 존재하는 gp91phox, p22phox, 세포질(cytosolic)에 존재하는 gp47phox, gp40phox 그리고 small GTP-결합 단백질인 Rac과 복합체를 이뤄 NADPH 산화효소의 기능은 조절된다.
NADPH 산화효소는 현재까지 NADPH 산화효소 1-5 그리고 dual 산화효소(dual oxygenase, DUOX) 1, 2가 존재하며 이들 종류에 따라 존재하는 세포, 장소 및 기능에 차이가 있음이 밝혀졌다.
세포 내 활성 산소종은 생성과 항산화 시스템(antioxidant system)의 제거에 의한 균형에 의해 일정 소량의 활성 산소종의 양이 존재하고 이를 통해 성장 및 분화뿐만 아니라 여러 신호전달경로에도 중요한 역할을 한다. 하지만 활성 산소종의 과도한 생성은 산화적 스트레스(oxidative stress) 유도 및 세포의 산화-환원 (redox) 반응의 불균형을 초래해 세포 항상성(homeostasis)을 파괴하고 세포 손상을 유발해 궁극적으로 여러 병리적 장애(암, 당뇨병, 뇌 질환 등)를 일으킨다.
필자는 “플라즈마 처리 시 세포 내에서 활성 산소종이 증가하는 것은 플라즈마 자체 또는 화학반응에 기인하는 것도 있겠지만 세포 내의 활성 산소종 생성 시스템이 활성화돼 활성 산소종이 생성되지 않을까?” 하는 호기심을 바탕으로 연구를 시작했다. 그래서 세포에 플라즈마를 처리하고 활성 산소종 생성 시스템의 mRNA 발현을 확인한 결과 활성 산소종 생성 시스템의 대표 주자인 NADPH 산화효소의 발현이 증가한 것을 확인하면서 본격적인 연구가 진행됐다.
최근 환경적 요인에 따른 후성유전학적 변화(epigenetic alteration)가 유전자 발현에 관여한다는 연구가 대두됨에 따라 NADPH 산화효소의 발현을 후성 유전학적 측면에서 특히 DNA 메틸화와 히스톤 변형 측면에서 연구했다. 참고로 유전자 발현은 크게 유전학적(genetic)과 후성 유전학적(epigenetic) 변화에 의해 영향을 받는다.
유전학적 발현은 DNA 염기 서열상의 변화(점 돌연변이 point mutation, 결실 deletion, 증폭 amplification)에 의해 유전자 발현이 조절되는 반면에 후성 유전학적 발현은 DNA 염기서열의 변화 없이 프로모터 메틸화(promoter methylation)와 히스톤 메틸화(histone methylation), 히스톤 아세틸/탈아세틸화(histone acetylation/deacetylation) 등과 같은 히스톤 변형(histone modification) 등의 염색체 재배열(chromatin remodeling)에 의해 유전자 발현이 조절된다.
연구 결과, 세포에 플라즈마를 처리하지 않은 상태에서는 NADPH 산화효소 프로모터(promoter) 부위에 후성 유전학적 조절 억제인자(epigenetic repressor)인 DNMT, EZH2, HDAC이 결합해 NADPH 산화효소의 발현을 억제함으로써 활성 산소종이 생성되지 않음을 확인했다(위 그림).
하지만 플라즈마 처리 시 후성 유전학적 조절 억제인자가 떨어져 나가고 대신 그 자리에 후성 유전학적 조절 활성 인자(epigenetic activator)인 TET, MLL, HAT이 안착해 NADPH 산화효소 발현을 유도함으로써 활성 산소종이 생성됨(아래 그림)을 규명했다(Redox Biology, 2020).
즉, 플라즈마 처리 시 세포 내 활성 산소종은 플라즈마 자체 또는 화학 반응에 의해서도 생성되지만, 생물학적으로 세포 내 활성 산소종 생성 시스템을 자극해 활성 산소종이 생성됨을 처음으로 규명했다. 처음에는 생소한 영역에 접근하면서 두려움과 초조함이 앞섰지만, 호기심을 가지고 시작했던 가설이 실험적으로 증명되는 기쁨을 맛봤다.

