세포사멸 담당자 sFasL의 또다른 역할

김혜성
의과대학 학술연구교수
류마티스 관절염(Rheumatoid Arthritis)은 유전적, 환경적 그리고 면역학적 요인이 서로 복잡하게 연관되어 발생하는 대표적인 자가 면역 질환이다. 주로 남성보다는 여성에서 발병 빈도가 높고, 전 연령에서 나타날 수 있지만, 40-50대의 중년층에서 많이 발생한다. 전 세계적으로 2억명이 넘는 인구가 류마티스 관절염을 앓고 있다.
자가 면역 질환이란 인체 내 특정 유전인자를 가지고 있는 사람이 외부의 유발인자에 의해 면역 조절계가 이상을 일으켜 자기 조직이나 세포를 해로운 존재로 인식하고 공격하게 되는 질환으로, 류마티스 관절염 환자들은 관절이 손상되는 만성 전신성 염증반응을 겪게 되며 손가락이나 발가락 등 말초 관절의 활막(synovium)에 염증, 활막 세포(synovial cells)의 비정상적인 증식, 면역세포의 침윤, 신생 혈관의 생성 등이 나타난다.
활막 세포(synovial cells)는 본래 관절을 구성하는 기본세포로, 관절을 지지하고 양분을 공급하는 역할을 한다. 그렇지만 류마티스 관절염과 같이 만성 염증이 일어나는 동안에는 오히려 관절 파괴의 주범으로 바뀌고 만다.
특히 활성화된 활막 섬유화 세포(synovial fibroblast)는 비상적으로 증식하여 연골 파괴와 뼈 침식에 앞장서는 공격적인 성향을 가지게 된다. 이러한 활막 세포(synovial cells)의 비정상적인 증식은 세포자멸(Apoptosis) 기전이 제대로 작동하지 않아 발생한다고 보고되어 있다.
세포자멸(Apoptosis)은 ‘세포자살‘이라고도 불리는데, 명칭 그대로 세포가 스스로 죽음을 선택하는 과정이다. 어쩐지 무시무시한 느낌이 들지만, 생명을 유지하기 위한 필수적인 죽음이라고 할 수 있다.
우리 몸을 이루는 약 60조개 세포의 생장은 우리의 삶과 죽음과도 연결되어 있으며, 건강하게 수명을 유지하기 위해서는 노화가 되거나 손상되어 비정상적으로 분열하는 세포들이 새로운 건강한 세포로 바뀌는 작업들이 굉장히 중요하다.
그렇지만 이러한 세포자멸(Apoptosis)이 제대로 일어나지 않으면 비정상적으로 세포가 증식되거나, 이러한 이상 증식 세포 자체가 비정상적인 염증반응의 매개체가 되기도 한다.
세포자멸(Apoptosis)을 유도하는 대표적인 신호전달체계중 하나가 수용체 Fas 와 리간드 FasL 단백질의 결합이다. 그렇기 때문에 류마티스 관절염 병인연구에서 Fas-FasL의 신호전달은 활막세포의 비정상적인 증식을 억제하는 우리몸의 방어기전으로 여겨졌다.
본 연구에서는 세포자멸(Apoptosis)의 필수요소인 FasL의 구조 중 세포막 바깥의 부분이 잘려나가 soluble FasL(sFasL)로 분비되면 세포자멸(Apoptosis)을 유도하는 것이 아니라 Fas가 아닌 다른 수용체와 결합하여 오히려 염증을 촉진하는 역할을 한다는 것을 보고 하였다.
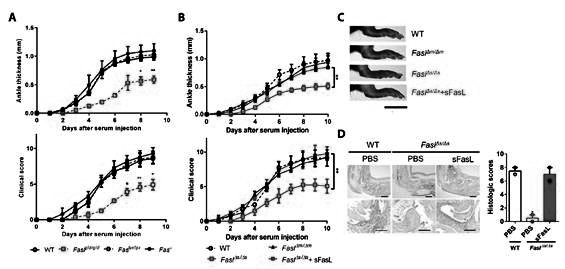
정상 대조군(WT), Fas가 결핍된 마우스 (Faslpr/lpr), FasL가 결핍된 마우스 (Faslpr/lpr)에 관절염을 유도하였더니, 예상과는 다르게 FasL가 결핍된 마우스 (Faslpr/lpr)에서만 관절염이 억제 되었다. 또한 FasL가 결핍된 마우스(Faslpr/lpr)에 soluble FasL 단백질을 주입하게 되면 다시 관절염이 악화되었다. (그림 1)
FasL가 결핍된 마우스 (Faslpr/lpr)에서는 다른 두 실험군과 비교하여 관절내 사이토카인 IL-1, TNF-α, IL-6, 염증 케모카인 CCL-2, CCL-3 그리고 CXCL-10이 감소되어 염증의 정도가 현저히 줄어든걸 알 수 있었다.
특히, FasL가 결핍된 마우스 (Faslpr/lpr)와는 달리 Fas가 결핍된 마우스(Faslpr/lpr)는 대조군과 차이를 보이지 않았다. 이는 FasL가 관절염을 유발하는 기전이 Fas와는 별개로 이루어짐을 시사하며, 놀랍게도 관절염 모델에서 FasL는 Fas가 아닌 종양 괴사 인자 수용체 슈퍼패밀리인 DR5/TRAIL-R2 와 특이적으로 상호 작용한다는 것을 발견했다.
DR5와 FasL의 상호작용은 케모카인 CX3XL1의 분비를 유도하고, 이는 관절 내로 염증 세포의 유입을 촉진하여 관절염을 악화시켰다. DNA microarray로 관절염 유도후 FasL 유무에 따른 유전자 발현을 스크리닝 하였고, 대조군, Fas가 결핍된 마우스 (Faslpr/lpr)와 비교하여 FasL가 결핍된 마우스 (Faslpr/lpr)의 관절 세포에 케모카인 CX3CL1의 발현이 두드러지게 감소되어 있었다.
수년간 비스테로이드 소염제, 항류마티스약제 그리고 관절 내 스테로이드 주입 등 여러 방법으로 류마티스 관절염이 치료되어 왔는데, 그동안의 치료 결과들을 보면 대부분의 환자가 지속적인 치료에도 불구하고 관절염이 계속 진행한다는 한계가 존재했다.
증상의 호전에는 차도를 보였지만 결국에는 류마티스 환자들의 관절 손상은 막을 수가 없었다. 물론 류마티스 관절염 치료제 시장을 장악하고 있는 TNF-α 억제제인 레미케이드(Remicade), 엔브렐(Enbrel), 휴미라(Humira)등 생물학적 제제가 강력하고 효과적인 치료제로 사용되고 있지만, 투여 방법이나 경제적인 면에서 부담을 무시하기는 힘들다.
앞서서 언급했듯이 류마티스 관절염은 매우 복잡한 기전으로 발병하고 진행된다. 하지만 결국은 서로 얽혀있는 복잡한 병인 기전에 대한 충분한 이해가 궁극적으로 류마티스 관절염의 예방이나 효과적인 치료법의 개발로 연결될 수 있을 것이다.
관절의 손상은 환자의 절반 이상이 류마티스 관절염 발병 후 첫 2년내에 발생한다고 보고되어 있다. 이는 류마티스 관절염을 치료하기 위해서는 관절염 초기에 좀 더 적극적인 치료의 접근이 필요하다는 것을 의미한다.
이러한 문제점의 극복을 위한 실마리중 하나를 본 연구에서 찾았다고 생각한다.
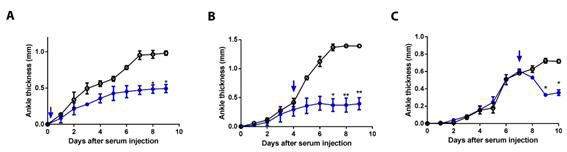
FasL의 활성을 억제하는 항체를 주입하면, 관절염의 진행이 대조군과 뚜렷한 차이를 보였다. 관절염을 유도하기 이전, 관절염 유도 초기 그리고 관절염 발생 이후로 나누어서 FasL 의 활성을 억제하는 항체를 주입하였고, 세가지 경우 모두 관절염이 진행이 효과적으로 억제되었다. (그림 2) 즉, FasL 활성의 억제는 관절염의 예방 (그림 2A), 진행 (그림 2B), 치료 (그림 2C) 에 폭넓게 적용이 가능함을 증명하는 결과라고 할 수 있다.
현재까지 류마티스 관절염의 병인에 대한 많은 연구가 이미 이루어졌지만 아직 미지의 영역들이 많기 때문에 이를 하나씩 밝혀내는것이 관절염 연구자들이 풀어가야할 숙제이다.
위의 연구논문은 류마티스 관절염의 새로운 발병 기전을 밝혀냈으며, 이는 노령화로 인해 확대되고 있는 류마티스 관절염 시장의 잠재적인 치료제 표적의 발굴이 가능할 것으로 기대된다.

