황색포도상구균에서의 PemI의 역할

2020년 세계보건기구(WHO) 보고서에 따르면 대부분의 신규 항생제들은 슈퍼박테리아에 취약하며, 최근 개발 중인 신규 항생제들은 그람 음성 병원균이 주 표적이므로 항생제 스펙트럼이 넓지 못한 것으로 나타났다. 이에 따라서, 사망률이 매우 높은 패혈증 등을 일으키는 그람 양성균인 메티실린 내성 포도상구균(MRSA) 등에 대한 신규 항생제 개발이 시급한 실정이다.
본 연구에서는 병원균의 항생제 내성 문제를 우회하기 위해 병원균에 내재한 독소 단백질의 제어를 방해하여 세포자살을 유도하는 기작을 토대로 하는 약물 개발의 중요성을 인식하였고 이를 해결할 수 있는 독소-항독소 단백질관련 연구를 수행했다.
그람 양성균인 포도상구균 유래의 독소단백질 PemK와 항독소단백질 PemI에 대해 결정화 테스트 및 최적화 작업을 통해 고질의 결정을 성장시켰고, X-선 결정학법을 이용해 두 종류의 단백질(독소 단백질과 독소-항독소 결합단백질)의 삼차원 구조를 해석했다. 이 과정에서 항독소 단백질 PemI가 독소 단백질 PemK의 일부 구조를 모방하는 독특한 작용을 이용해 상호 결합함을 관찰했다.
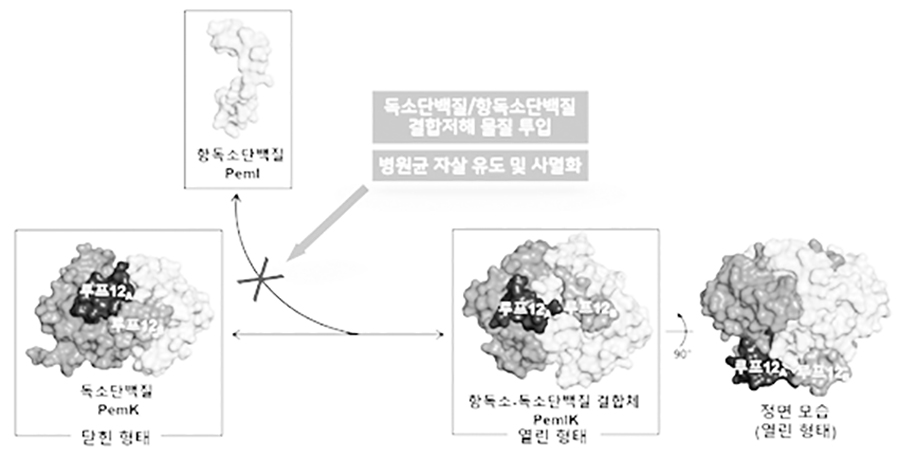
확보한 단백질 구조들을 비교, 분석하여 독소단백질의 효소활성화 부위 및 항독소단백질의 기능을 밝히고자, 돌연변이법(mutagenesis)을 이용해 다양한 돌연변이 단백질을 생산한 뒤 효소활성화 분석법을 통해 독소단백질이 병원균의 전령알엔에이(mRNA)를 분해하는 것을 밝혔고 중요 아미노산들(amino acids 의 정보를 밝혀냈다.
독소단백질의 구조변화를 세밀히 분석하고자 핵자기공명법(NMR)및 시뮬레이션분석법(MD simulation)을 활용해 수용액 상태에서의 단백질의 구조 변화를 관찰하고 예측했다. 분석한 결과를 토대로 독소 단백질이 항독소 단백질과 결합할 때 구조 변화가 갖는 의미를 분석해, 열림 형태/닫힘 형태의 독소 단백질의 특징과 항독소 단백질과의 결합 부위를 밝혔다.
황색 PemIK TA 모듈은 LCN 플라스미드 R100에서 최초로 검출됐다. 복제원점 근처에 위치한 두 개의 대응하는 유전자는 R100의 안정적인 유지에 관여한다. 포도상구균속에서는 단백질 배열의 생물 정보학 분석에 근거해 pemIK 궤적은 플라스미드뿐만 아니라 염색체(28)에도 위치한다는 것을 밝혔다.
본 연구에서는 PemK 및 PemI 중화 PemK 구조와 PemK 활성 및 PemI 간섭에 관한 상세한 기계적 증거를 제시한다. 결론적으로 PemK 관련 단백질이 각 유기체에서 생리 활동을 수행하는 독특한 방법을 가지고 있음을 보여준다.
특히, 본 연구에서는 긴 루프 L12의 중요성과 L12의 큰 구성 변화의 중요성을 밝히고, 이는 PemK와 PemIK의 구조적인 비교를 통해 확인됐다. 또한 시뮬레이션분석법(MD simulation) 결과는 PemK L12의 유연한 특성도 지원했다. PemK의 L12는 PemI 항독소 결합의 게이트 역할을 할 수 있다. PemK 호몰로그의 결과 중 하나는 L34, L45 및 L67 루프의 유연성과 길이였다.
또한 PemK 표면의 틈새에 양전하 잔류물의 다른 분산도 존재한다. 독소 프로테인의 이러한 특성은 특정 RNA 또는 항독소와 결합하기 위한 구조를 결정할 수 있다.
이전의 여러 연구에서는 PemK 호몰로그의 촉매 잔류물이 밝혀졌다. 탄저병의 원인이 되는 세균의 MoxT에서는 His59와 Glu78이 촉매산염기쌍으로 예측되며 안정화 잔류물은 Gln21과 Gln79(55)였다. Kid from E. coli에서는 RNA의 Uracil 2 OH, 촉매산은 Arg73 및 His17, 촉매염기는 Asp75(56)로 보고되었다.
그러나 PemK와 호몰로그의 배열 정렬을 수행했을 때 이러한 잔류물은 보존되지 않았다. 기타 잔류물인 PemK의 Arg25 및 Thr48은 B. 서브틸리스에 서 MazF에서 Arg25 및 Thr48로, 대장균에서 MazF에서 Arg29 및 Thr52로 보존된다.
B. 서브틸리스로부터의 MazF에서는 Arg25가 P-O 결합(46)의 난할을 안정시킬 것으로 예측된다. 대장균의 MazF에서 Arg29는 일반산 및 일반염기로 작용하고, Thr52는 안정화 잔류물(49)로 작용한다.
당사의 비교 분석 결과, 황색포도상구균의 PemK는 잔류물 Arg25 및 Thr48의 산염기 촉매 분해에 의해 매개되는 mRNA 절단에도 관여할 수 있다. 황색포도상구균의 PemK에 대한 구조적 및 기능적 연구는 Arg84 외에 Arg25와 Thr48이 PemK 활성에 중요한 역할을 한다는 것을 밝혀냈다. Arg25는 일반산과 염기의 역할을 하며, Thr48은 촉매 반응에서 전이 상태를 안정화시킨다는 가설이다.
Arg 잔기의 이러한 관여는 대장균 MazF 및 B. 서브틸리스 MazF(46,49)와 같은 다른 호몰로그에서 나타났다. 흥미롭게도 Arg84는 이전 연구에서 주요 잔류물로 제시됐다. Arg84는 ssRNA-PemK 컴플렉스 모델에서 ssRNA와 직접 연계되지 않는다.
단, Arg84는 돌연변이 RNase 활성 저하와 RNA 결합 친화력을 보였다. Arg84의 이러한 잠재적 역할은 RNA 기질에 촉매적으로 최적의 닫힌 형태를 유지하는 수소 결합의 관여에서 비롯될 수 있다.
리보솜의 존성 RNase로서 PemK와 그 호모로그는 특정 mRNA 서열을 인식한다. PemK의 가장 중요한 기능은 UAUU를 포함하는 특정 테트라 mRNA 서열을 인식하고 분해하는 것이다. RNA 배열 UAUU는 Tyr 또는 Ile로 더 번역될 수 있는 코돈 또는 안티코돈일 수 있다. 이러한 선택적 성분의 분해와 후속 성장 인히비전은 황색포도상구균(17)에서 PemK의 독성을 입증한다. TA복합체의 포메이션에 의해 독소의 리보솜의 존성 RNase 활성을 억제할 수 있으며, TA복합체는 독소에 의한 전령알엔에이(mRNA) 결합을 철저히 차단한다.
PemI 중화 PemK 구조에 따르면 PemI의 γ-헬리컬 독소결합 모티브는 활성 부위 전기에 결합함으로써 PemK를 닫힌 형태에서 열린 형태로 입체적으로 재배치한다. 최근 연구에서 독소-항독소 복합체를 교란하고 세포 사망으로 이어지는 독소의 인위적 활성화를 유도하도록 설계된 구조 기반의 작은 분자 또는 페페티드가 발견되었다.
이러한 전략과 더불어, 병원균의 표적 살해를 위한 항시약으로서 재로로 작용된 독소가 연구됐다. 본 연구는 연구자들이 의사펩타이드 또는 작은 분자의 형태로 억제제를 발견할 수 있도록 하는 독소 단백질 PemK에 대한 구조 정보를 제공한다. 잠재력억제제는 영구적인 독소 활성화를 유발하여 황색포텐과 같은 세균성 병원균의 세포사를 초래할 수 있다.
병원균에는 다양한 독소단백질과 항독소단백질이 존재하는데, 본 연구에서 밝힌 표적 단백질인 항독소단백질 PemI의 경우 매우 독특한 방법으로 독소단백질 PemK와 결합함을 처음으로 밝혀냈다.
이러한 결합 방법은 항독소단백질 자체 구조를 독소단백질의 형태를 모방하여 결합하는 방식이므로, 기존에 개발된 약물과는 매우 다른 형태로 약물 설계가 가능하다는 점에서 기존 연구들과 차이가 매우 크다. 본 연구 결과는 병원균들이 스스로 사멸하게 유도할 수 있는 신개념 항생제 설계의 토대를 제시하였고 Nucleic Acids Research (Impact Factor 16.971) 학술지에 발표했다.

